- Product
- Suppliers
- Manufacturers
- Solutions
- Free tools
- Knowledges
- Experts
- Communities
Search
-
Instrumenta libera
-
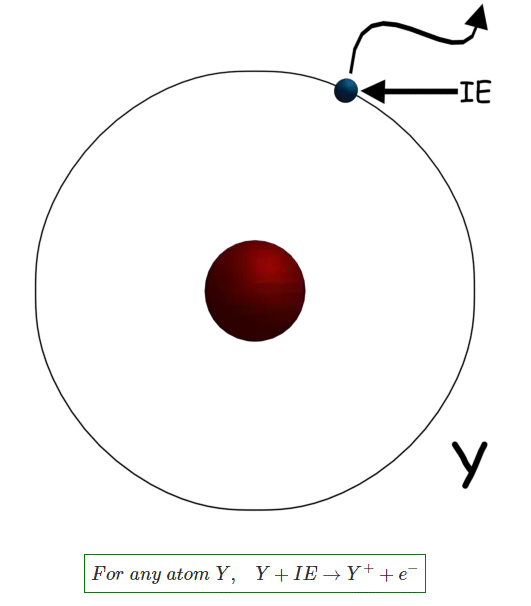
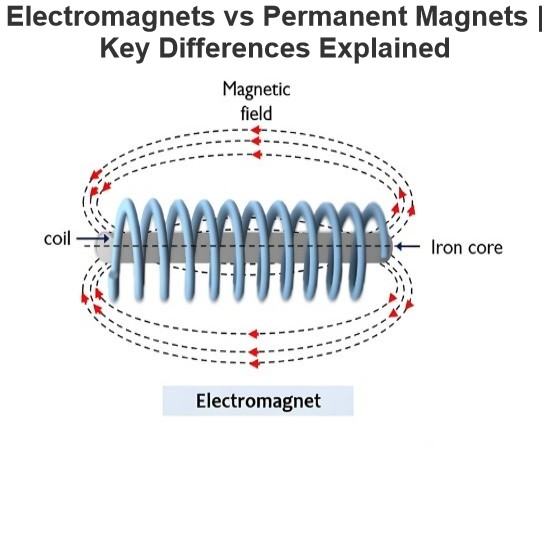
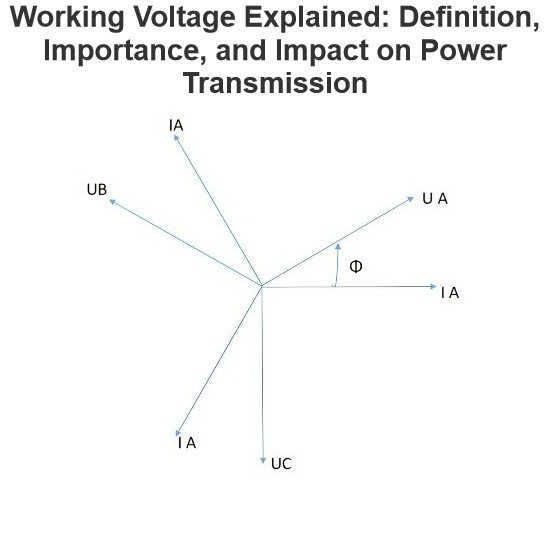
IEE Business praebet instrumenta gratuita AI potentiata pro designo ingeniariorum electricorum et computatione budgeti emptionis potentiae electriae parametris tuis insertis calculare clicto resultata instantanea de transformatoribus cabling motoribus costibus aequipmentorum potentiae electriae et aliis fideliter probata per ingeniaros universales
-
-
Subsidium
-
IEE-Business praebet solutiones principales negotiationes et peritos - creans platformam ubi innovatio coniungitur cum valoreScientia technica excellensConiunge et divide scientiam technicam ut pecuniam a sponsoribus quaerasOptimae Solutio NegotiabilisAdiungere et creare solutiones commerciales ad lucrum ex sponsoribus lucrandumExperti Individui EximiiTalentum tuum demonstra sponsoribus futurumque cape
-
-
Communitas
-
Construe communitatem tuam professionalemInveni et coniunge cum sodalibus industriae, sociis potentiis et moderatoribus ut negotium augereturAmplia Tuum Nectum PersonaleConnecte cum paribus industriae, sociis potentiabilibus et factoribus decisionum ad accelerandum tuum incrementum.Discoperi Plus OrganisationesExplorare societates, collaboratores et duces industriae ad res novas IEE-Business aperireAdiungere Communitatibus DiversisParticipa in disputationibus thematicis, communicationibus industrialibus et communicatione facultatum ut auxilias tuum impetum.
-
-
Cooperatio
Socius
-
-
Praebe IEE Business Societatis ProgrammaPotentia Crescendi Negotiis Ab Instrumentis Technicis Ad Expansionem Negotiorum Globalium
-
-
IEE Business
-
Latina
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
-
Latina
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-