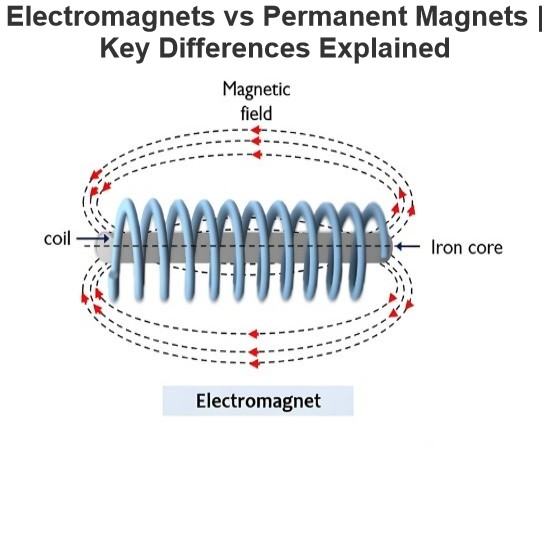
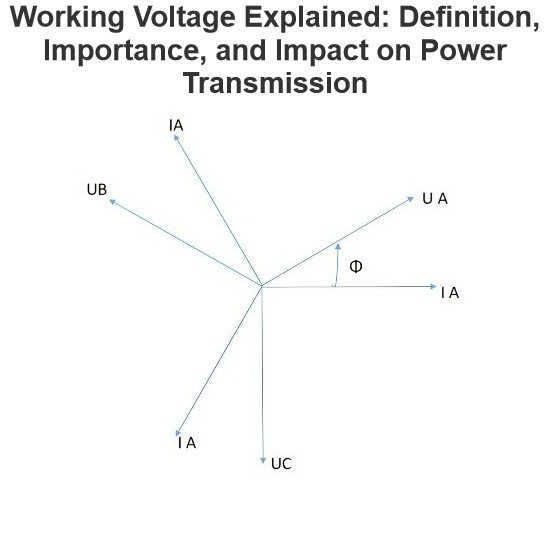
- Product
- Suppliers
- Manufacturers
- Solutions
- Free tools
- Knowledges
- Experts
- Communities
Search
-
Бесплатные инструменты
-
IEE Business предлагает бесплатные инструменты на основе ИИ для проектирования электротехнических систем и бюджетирования закупок электроэнергии: введите параметры нажмите рассчитать и получите мгновенные результаты по трансформаторам проводке двигателям стоимости энергетического оборудования и многому другому доверяемые инженерами по всему миру
-
-
Поддержка и спонсорство
-
IEE-Business поддерживает передовые решения бизнесы и эксперты создавая платформу где инновации встречаются с ценностьюВыдающиеся технические знанияПрисоединяйтесь и делитесь техническими знаниями чтобы зарабатывать деньги от спонсоровОтличные бизнес-решенияПрисоединяйтесь и создавайте бизнес-решения для заработка на спонсорахВыдающиеся индивидуальные экспертыПродемонстрируйте ваш талант спонсорам и обеспечьте свое будущее
-
-
Сообщество
-
Создайте свое профессиональное сообществоНайдите и подключитесь к профессиональным коллегам, потенциальным партнерам и лицам, принимающим решения, чтобы развивать свой бизнес.Расширьте свою личную сетьСоединяйтесь с коллегами по отрасли, потенциальными партнерами и лицами, принимающими решения, чтобы ускорить свой рост.Обнаружить дополнительные организацииИзучайте целевые компании, партнёров и лидеров отрасли для раскрытия новых бизнес-возможностейПрисоединиться к разнообразным сообществамУчаствуйте в тематических обсуждениях, отраслевых обменах и совместном использовании ресурсов для усиления вашего влияния
-
-
Сотрудничество
Партнеры
-
-
Присоединиться к программе партнерства IEE-BusinessСтимулирование роста бизнеса — от технических инструментов к глобальному расширению бизнеса
-
-
IEE Business
-
Русский язык
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
Выдающиеся индивидуальные эксперты
Обнаружить дополнительные организации
-
Русский язык
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
Бесплатные электрические калькуляторы
Выдающиеся индивидуальные эксперты
Обнаружить дополнительные организации