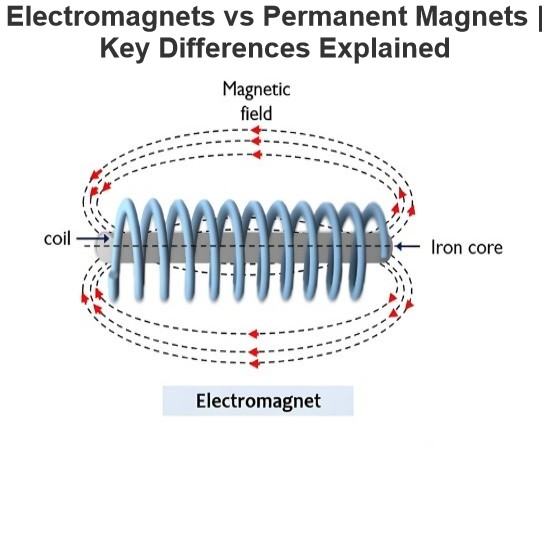
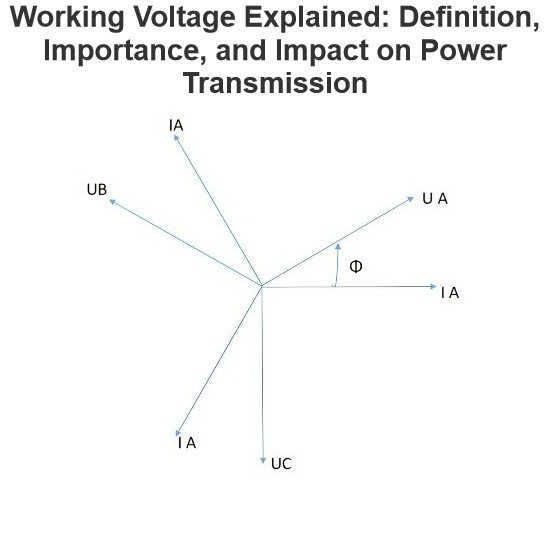
- Product
- Suppliers
- Manufacturers
- Solutions
- Free tools
- Knowledges
- Experts
- Communities
Search
-
ਫਰੀ ਟੂਲਜ਼
-
ਆਈਈਈ-ਬਿਜ਼ਨਸ ਬਿਜਲੀ ਇੰਜੀਨੀਅਰਿੰਗ ਡਿਜ਼ਾਈਨ ਅਤੇ ਪਾਵਰ ਖਰੀਦ ਬਜਟਿੰਗ ਲਈ ਮੁਫ਼ਤ, ਏਆਈ-ਸਹਾਇਤ ਉਪਕਰਣ ਪ੍ਰਦਾਨ ਕਰਦਾ ਹੈ: ਆਪਣੇ ਪੈਰਾਮੀਟਰ ਦਰਜ ਕਰੋ, ਗਣਨਾ 'ਤੇ ਕਲਿੱਕ ਕਰੋ, ਅਤੇ ਟਰਾਂਸਫਾਰਮਰਾਂ, ਵਾਇਰਿੰਗ, ਮੋਟਰਾਂ, ਪਾਵਰ ਉਪਕਰਣਾਂ ਦੀਆਂ ਲਾਗਤਾਂ ਅਤੇ ਹੋਰ ਬਹੁਤ ਕੁਝ ਲਈ ਤੁਰੰਤ ਨਤੀਜੇ ਪ੍ਰਾਪਤ ਕਰੋ - ਦੁਨੀਆ ਭਰ ਦੇ ਇੰਜੀਨੀਅਰਾਂ ਵੱਲੋਂ ਭਰੋਸਾ ਕੀਤਾ ਗਿਆ।
-
-
ਸਹਾਇਤਾ ਅਤੇ ਸਪੋਨਸਰਸ਼ਿਪ
-
IEE-Business ਵਿਸ਼ੇਸ਼ ਸਮਾਧਾਨਾਂ ਨੂੰ ਸਹਿਯੋਗ ਦਿੰਦਾ ਹੈ ਜਾਂ ਕਾਰੋਬਾਰਾਂ ਅਤੇ ਵਿਸ਼ੇਸ਼ਜਣਾਂ ਨੂੰ ਪ੍ਰਦਾਨ ਕਰਦਾ ਹੈ ਜਿਸ ਦੁਆਰਾ ਇਨੋਵੇਸ਼ਨ ਅਤੇ ਮੁੱਲ ਦੀ ਇਕ ਪਲੈਟਫਾਰਮ ਬਣਦੀ ਹੈਲਭਦੀਆ ਟੈਕਨੀਸ਼ਲ ਗyaanਜੌਇਨ ਕਰੋ ਅਤੇ ਸਪੌਂਸਰਾਂ ਤੋਂ ਪੈਸਾ ਕਮਾਉਣ ਲਈ ਟੈਕਨੀਕਲ ਗਿਆਨ ਸਾਂਝਾ ਕਰੋ।ਲਾਭਦਾਇਕ ਵਿਗਿਆਨਕ ਹੱਲਾਤਜੋਇਨ ਅਤੇ ਬਿਜ਼ਨੈਸ ਸੰਖਿਆਵਾਂ ਦੀ ਪ੍ਰਦਾਨਕਾਰੀ ਕਰਕੇ ਸਪੰਸਰਾਂ ਤੋਂ ਪੈਸਾ ਕਮਾਓਉਤਕ੍ਰਿਸ਼ਟ ਵਿਅਕਤੀਗਤ ਵਿਸ਼ੇਸ਼ਜਣਾਂਟੈਲੈਂਟ ਸ਼ੋ ਨੂੰ ਸਪੰਸਰਾਂ ਨੂੰ ਪ੍ਰਦਰਸ਼ਿਤ ਕਰੋ ਅਤੇ ਆਪਣੇ ਭਵਿੱਖ ਨੂੰ ਜਿੱਤੋ
-
-
ਕਮਿਊਨਿਟੀ
-
ਆਪਣੀ ਪੇਸ਼ੇਵਰ ਕਮਿਊਨਿਟੀ ਬਣਾਓਆਈਈਈ-ਬਿਜ਼ਨਸ ਨਾਲ ਉਦਯੋਗ ਸਾਥੀਆਂ, ਸੰਭਾਵੀ ਭਾਈਵਾਲਾਂ ਅਤੇ ਫੈਸਲਾ ਲੈਣ ਵਾਲਿਆਂ ਨੂੰ ਲੱਭੋ ਅਤੇ ਜੁੜੋ ਤਾਂ ਜੋ ਆਪਣਾ ਕਾਰੋਬਾਰ ਵਧਾ ਸਕੋ।ਆਪਣੇ ਵਿਅਕਤੀਗਤ ਨੈੱਟਵਰਕ ਨੂੰ ਵਧਾਓਉਦਯੋਗ ਦੇ ਸਾਥੀਆਂ, ਸੰਭਾਵੀ ਭਾਈਵਾਲਾਂ ਅਤੇ ਫੈਸਲਾ ਲੈਣ ਵਾਲਿਆਂ ਨਾਲ ਜੁੜੋ ਤਾਂ ਜੋ ਤੁਹਾਡੀ ਵਿਕਾਸ ਨੂੰ ਤੇਜ਼ ਕੀਤਾ ਜਾ ਸਕੇ।ਹੋਰ ਸੰਗਠਨਾਂ ਦੀ ਖੋਜ ਕਰੋਟੀਚਾ ਕੰਪਨੀਆਂ, ਸਹਿਯੋਗੀਆਂ ਅਤੇ ਉਦਯੋਗ ਨੇਤਾਵਾਂ ਦੀ ਖੋਜ ਕਰਕੇ ਨਵੇਂ ਵਪਾਰਕ ਮੌਕੇ ਖੋਲ੍ਹੋ।ਵੱਖ-ਵੱਖ ਕਮਿਊਨਿਟੀਆਂ ਵਿੱਚ ਸ਼ਾਮਲ ਹੋਵੋਵਿਸ਼ੇ-ਅਧਾਰਤ ਚਰਚਾਵਾਂ, ਉਦਯੋਗ ਲੈਣ-ਦੇਣ ਅਤੇ ਸਰੋਤ ਸਾਂਝ ਵਿੱਚ ਸ਼ਾਮਲ ਹੋਵੋ ਅਤੇ ਆਪਣੀ ਪਹੁੰਚ ਨੂੰ ਵਧਾਓ।
-
-
ਸਾਡੇ ਨਾਲ ਭਾਈਵਾਲ ਬਣੋ
ਪਾਰਟਨਰ
-
-
IEE Business ਵਿਚ ਸਹਾਇਕ ਪ੍ਰੋਗਰਾਮ ਵਿੱਚ ਸ਼ਾਮਲ ਹੋਣ ਲਈਵਿਗਾਨਕ ਸਹਾਇਤਾ ਲਈ ਵਿਗਾਨਕ ਸਹਾਇਕਾਂ ਤੋਂ ਵਿਸ਼ਵਵਿਅਕ ਵਿਗਾਨਕ ਵਿਚਕਾਰੀ ਵਿਚਕਾਰੀ ਵਿਚਕਾਰੀ ਵਿਚਕਾਰੀ 请注意,上述翻译可能存在错误。正确的翻译应为: ਵਿਗਾਨਕ ਵਿਕਾਸ ਦੀ ਸਹਾਇਤਾ -- ਟੈਕਨੀਕਲ ਸਹਾਇਕਾਂ ਤੋਂ ਗਲੋਬਲ ਵਿਗਾਨਕ ਵਿਸ਼ਵਵਿਅਕ ਤੱਕ
-
-
IEE Business
-
ਪੰਜਾਬੀ
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
ਉਤਕ੍ਰਿਸ਼ਟ ਵਿਅਕਤੀਗਤ ਵਿਸ਼ੇਸ਼ਜਣਾਂ
ਆਪਣੇ ਵਿਅਕਤੀਗਤ ਨੈੱਟਵਰਕ ਨੂੰ ਵਧਾਓ
-
ਪੰਜਾਬੀ
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
ਉਤਕ੍ਰਿਸ਼ਟ ਵਿਅਕਤੀਗਤ ਵਿਸ਼ੇਸ਼ਜਣਾਂ
ਆਪਣੇ ਵਿਅਕਤੀਗਤ ਨੈੱਟਵਰਕ ਨੂੰ ਵਧਾਓ