- Product
- Suppliers
- Manufacturers
- Solutions
- Free tools
- Knowledges
- Experts
- Communities
Search
-
Bezmaksas rīki
-
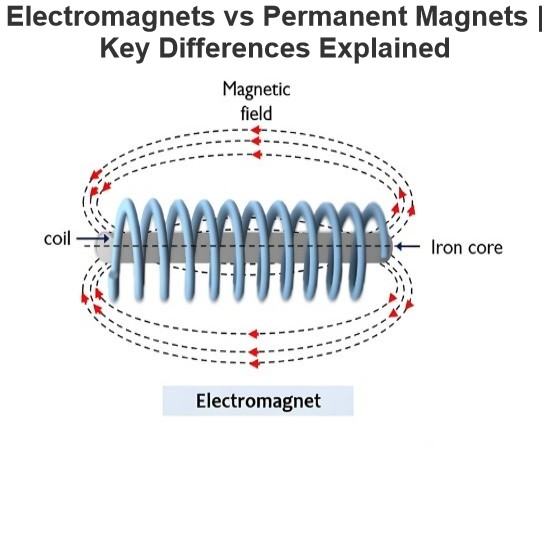
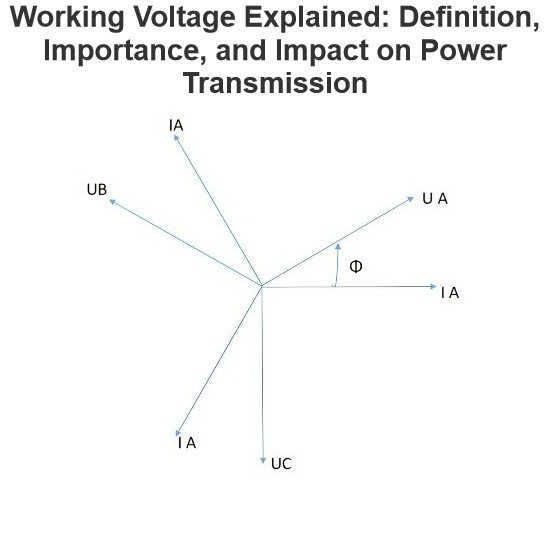
IEE Business piedāvā bezmaksas AI balstītas rīku elektrikumu inženierzinātnei un enerģijas iegādes budžetēšanai ievadiet parametrus noklikšķiniet uz aprēķina un saņemiet nekavējoties rezultātus par transformatoriem vadošanas līnijām dzinējiem enerģijas ierīču izmaksām un tālāk uzticami inženieri visā pasaulē
-
-
Atbalsts un sponsorēšana
-
IEE-Business atbalsta vadošās risinājumus uzņēmumus un ekspertus radot platformu kur inovācija sastopas ar vērtībuIzcelta tehniskā zināšanaPievienojieties un dalieties tehniskās zināšanās lai nopelnītu naudu no sponsoriemIzcilīgas Biznesa RisinājumiPievienojieties un izveidojiet biznesa risinājumus lai nopelnītu naudu no sponsoriemIzcilie individuālie ekspertiRādīt savas spējas sponsoriem iegūstot nākotni
-
-
Kopiena
-
Izveidojiet savu profesionālo kopienуAtrast un sazināties ar nozares līdziniekiem, potenciālajiem partneriem un lēmumu pieņēmējiem, lai attīstītu savu biznesu.Paplašini savu personīgo tīkluSazinieties ar nozares kolēģiem, potenciāliem partneriem un lēmumu pieņēmējiem, lai paātrinātu savu izaugsmi.Atrast vairāk organizācijuIzpētiet mērķa uzņēmumus, sadarbības partnerus un nozares līderus, lai atklātu jaunas biznesa iespējasPievienoties dažādām kopienāmPievienojieties tēmās veltītām diskusijām, nozares apmaiņai un resursu koplietošanai, lai pastiprinātu savu ietekmi.
-
-
Sadarboties ar mums
Sadarbinātājs
-
-
Pievienojies IEE Business partneru programmaiUzņēmuma izaugsmes veicināšana no tehniskiem rīkiem līdz globālai biznesa paplašināšanai
-
-
IEE Business
-
Latviešu valoda
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
Paplašini savu personīgo tīklu
-
Latviešu valoda
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
Paplašini savu personīgo tīklu