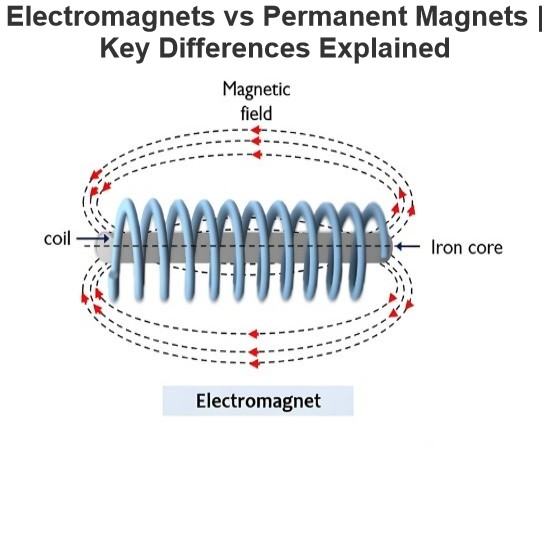
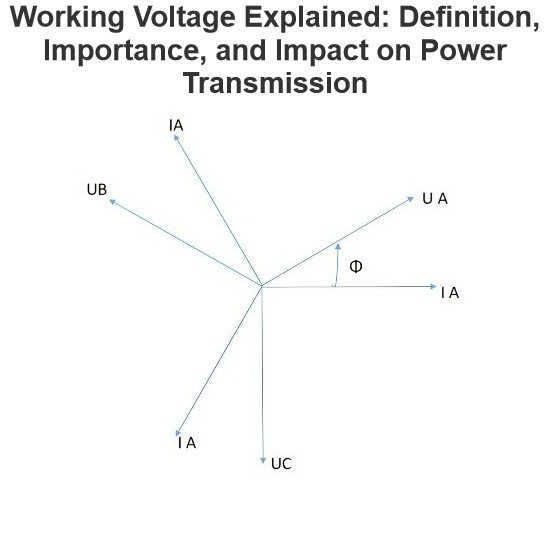
- Product
- Suppliers
- Manufacturers
- Solutions
- Free tools
- Knowledges
- Experts
- Communities
Search
-
Ferramentas gratuitas
-
IEE Business oferece ferramentas gratuitas baseadas em IA para design de engenharia elétrica e orçamentação de aquisição de energia digite seus parâmetros clique em calcular e obtenha resultados instantâneos para transformadores fiação motores custos de equipamentos elétricos e mais confiável por engenheiros em todo o mundo
-
-
Suporte e Patrocínio
-
IEE-Business apoia soluções líderes empresas e especialistas criando uma plataforma onde inovação encontra valorConhecimento técnico excelenteJunte-se e compartilhe conhecimentos técnicos para ganhar dinheiro de patrocinadoresSoluções de Negócios ExcelentesParticipe e crie soluções comerciais para ganhar dinheiro com patrocinadoresEspecialistas Individuais DestacadosMostre seu talento aos patrocinadores ganhe seu futuro
-
-
Comunidade
-
Construa sua comunidade profissionalEncontre e conecte-se com colegas do setor, parceiros em potencial e tomadores de decisão para expandir seu negócio.Expandir sua rede pessoalConecte-se com colegas do setor, parceiros potenciais e tomadores de decisão para acelerar seu crescimento.Descobrir Mais OrganizaçõesExplore empresas-alvo, colaboradores e líderes do setor para desbloquear novas oportunidades de negócio.Juntar-se a Comunidades DiversasParticipe em discussões temáticas, intercâmbios setoriais e compartilhamento de recursos para ampliar seu impacto.
-
-
Colabore Conosco
Parceiros
-
-
Participe do Programa de Parceiros IEE-BusinessImpulsionando o Crescimento do Negócio -- De Ferramentas Técnicas à Expansão Global
-
-
IEE Business
-
Português
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- Filipino
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
Conhecimento técnico excelente
Soluções de Negócios Excelentes
Especialistas Individuais Destacados
-
Português
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- Filipino
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
Calculadoras Elétricas Gratuitas
Conhecimento técnico excelente
Soluções de Negócios Excelentes
Especialistas Individuais Destacados