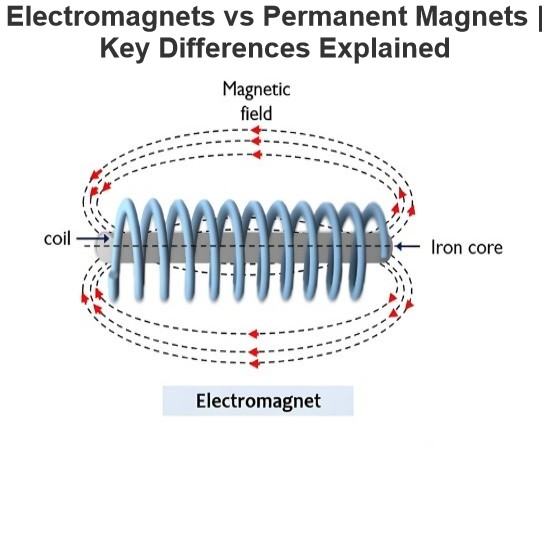
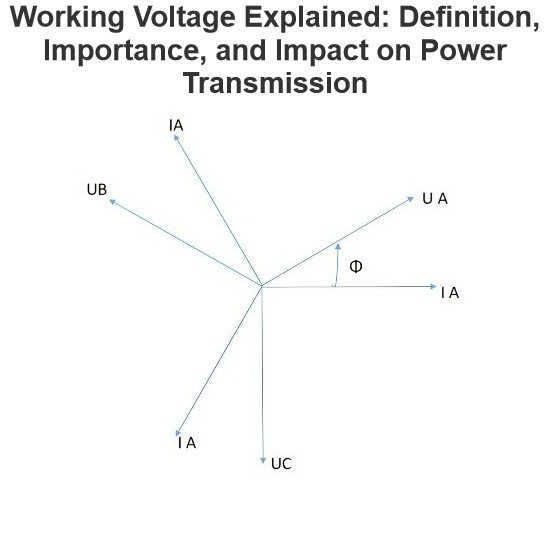
- Product
- Suppliers
- Manufacturers
- Solutions
- Free tools
- Knowledges
- Experts
- Communities
Search
-
Ücretsiz araçlar
-
IEE Business, elektrik mühendisliği tasarımı ve güç alımı bütçelemesi için ücretsiz, yapay zeka destekli araçlar sunar: parametrelerinizi girin, hesapla'ya tıklayın ve transformatörler, kablolar, motorlar, güç ekipmanı maliyetleri ve daha fazlası için anında sonuç alın — dünya çapındaki mühendisler tarafından güvenilir.
-
-
Destek ve Sponsorluk
-
IEE-Business öncü çözümleri işler ve uzmanları destekleyerek inovasyonun değerle buluştuğu bir platform yaratırBüyüleyici teknik bilgiTeknik bilgi paylaşarak sponsorlardan gelir elde etMükemmel İş ÇözümleriSponsorlardan gelir elde etmek için iş çözümlerine katılın ve oluşturunÖne Çıkan Bireysel UzmanlarYeteneklerinizi sponsorlara göster kazanın geleceğinizi
-
-
Topluluk
-
Profesyonel Topluluğunuzu OluşturunSizin işinizi büyütmesi için sektör meslektaşlarınızı, potansiyel ortaklarınızı ve karar vericileri bulun ve onlarla bağlantı kurun.Kişisel Ağınızı GenişletinSektör meslektaşlarınız, potansiyel ortaklarınız ve karar vericilerle IEE-Business üzerinden bağlantı kurarak büyümenizi hızlandırınDaha Fazla Kuruluş KeşfedinHedef şirketleri, iş birliklerini ve sektör liderlerini keşfedin ve yeni iş fırsatlarını açınÇeşitli Topluluklara KatılınKonu odaklı tartışmalara katılın, sektör paylaşımları yapın ve etkinizi artırmak için kaynak paylaşımı sağlayın
-
-
Bizimle İşbirliği Yap
Ortaklar
-
-
IEE Business İş Ortağı Programına Katılınİş Büyümesini Güçlendirme -- Teknik Araçlardan Küresel İş Genişlemesine Kadar
-
-
IEE Business
-
Türkçe
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- Filipino
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
-
Türkçe
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- Filipino
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
Ücretsiz Elektrik Hesap Makineleri