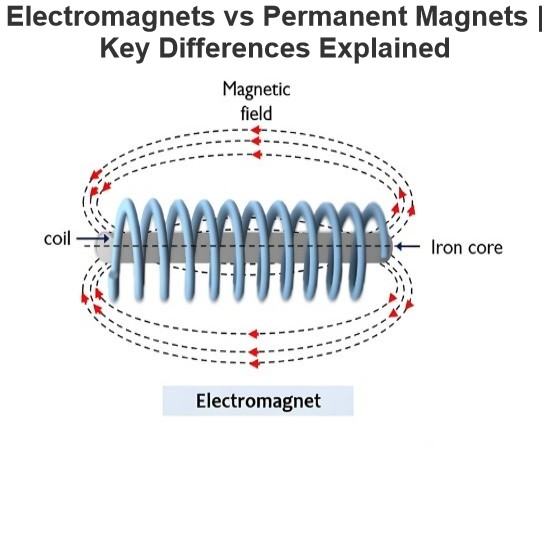
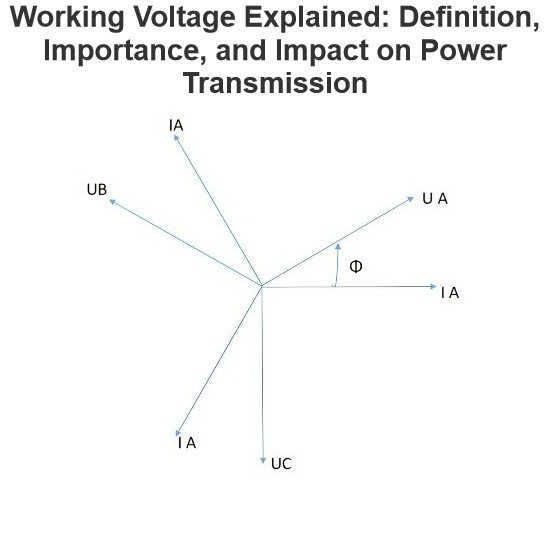
- Product
- Suppliers
- Manufacturers
- Solutions
- Free tools
- Knowledges
- Experts
- Communities
-
Mga Libreng Tool
-
IEE Business nagbibigay ng libreng mga kasangkapan na may AI para sa disenyo ng electrical engineering at pagsusumite ng budget para sa pagbili ng kuryente: ilagay ang iyong mga parameter, i-click ang kalkulahin, at makakuha agad ng resulta para sa mga transformer, wiring, motors, cost ng mga power equipment, at iba pa — pinagkakatiwalaan ng mga engineers sa buong mundo
-
-
Suporta
-
IEE-Business ay sumusuporta sa mga nangungunang solusyon, negosyo, at eksperto - lumilikha ng isang platform kung saan ang inobasyon ay nagtatagpo sa halagaKakayahan teknikal na kamangha-manghangSumali at Ibahagi Ang Teknikal na Kaalaman upang Kumita mula sa mga SponsorMga Solusyon sa Negosyo na MahusaySumali at lumikha ng mga solusyon sa negosyo upang kumita mula sa mga sponsorEksperyenteng IndibidwalIpakita ang iyong talento sa mga sponsor, kumita ng iyong kinabukasan
-
-
Komunidad
-
Itayo ang iyong propesyonal na KomunidadMaghanap at kumonekta sa mga kasamahan sa industriya, potensyal na mga kasosyo, at mga tagapagpasya upang palaguin ang iyong negosyo.Palawakin ang Iyong Personal na NetworkKumonekta sa mga kapantay sa industriya, potensyal na mga kasosyo, at mga tagapagpasya upang paikliin ang iyong paglago.Tuklasin ang Higit pang mga OrganisasyonAlamin ang mga target na kumpanya, kasosyo, at mga lider sa industriya upang magbukas ng mga bagong oportunidad sa negosyo.Sumali sa Iba't Ibang KomunidadSumali sa mga talakayang nakatuon sa paksa, palitan ng industriya, at pagbabahagi ng mga mapagkukunan upang palawakin ang iyong impluwensya.
-
-
Makipag-ugnayan
Partner
-
-
Sumali sa IEE Business Partner ProgramPagpapalakas ng Paglago ng Negosyo -- Mula sa Teknikal na Kasangkapan hanggang sa Pandaigdigang Pagpapalawak ng Negosyo
-
-
-
Tagalog
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
Kakayahan teknikal na kamangha-manghang
Mga Solusyon sa Negosyo na Mahusay
Palawakin ang Iyong Personal na Network
Tuklasin ang Higit pang mga Organisasyon
Sumali sa Iba't Ibang Komunidad
-
Tagalog
-
- English
- Afrikaans
- العربية
- Azərbaycan dili
- български
- বাংলা
- Català
- Cebuano
- čeština
- Dansk
- Deutsch
- Ελληνικά
- Esperanto
- Español
- Eesti keel
- Euskara
- دری
- فارسی
- suomi
- français
- Gaeilge
- Galego
- Hausa
- עברית
- हिन्दी
- Hrvatski
- magyar nyelv
- հայերեն
- Bahasa Indonesia
- Íslenska
- Italiano
- 日本語
- ქართული
- Қазақ тілі
- ಕನ್ನಡ
- 한국어
- Kurdî
- Latina
- Latviešu valoda
- македонски јазик
- Bahasa Melayu
- Malti
- नेपाली
- Nederlands
- Norsk
- ਪੰਜਾਬੀ
- polski
- پښتو
- Português
- Русский язык
- සිංහල
- Slovenščina
- српски језик
- Svenska
- Kiswahili
- தமிழ்
- తెలుగు
- ไทย
- Tagalog
- Türkçe
- українська мова
- اردو
- Oʻzbek tili
- Tiếng Việt
-
Mga Libreng Kalkuladora sa Kuryente
Kakayahan teknikal na kamangha-manghang
Mga Solusyon sa Negosyo na Mahusay
Palawakin ang Iyong Personal na Network
Tuklasin ang Higit pang mga Organisasyon
Sumali sa Iba't Ibang Komunidad