Magnesium wird als Anodematerial in primären Batterien verwendet, aufgrund seines hohen Standardpotentials. Es ist ein leichtes Metall und auch leicht verfügbar, da es ein kostengünstiges Metall ist. Die Magnesium/Mangan-Dioxid-Batterie (Mg/MnO2) hat doppelt so lange Haltbarkeit, d.h. Kapazität, wie die Zink/Mangan-Dioxid-Batterie (Zn/MnO2) gleicher Größe. Sie kann ihre Kapazität auch bei der Lagerung, selbst bei hohen Temperaturen, beibehalten. Die Magnesiumbatterie ist sehr widerstandsfähig und lagerfähig, da sie immer eine schützende Hülle hat, die sich natürlicherweise auf der Oberfläche des Magnesiumanoden bildet.
Die Magnesiumbatterie verliert ihre Lagerfähigkeit, sobald sie teilweise entladen wurde, und das ist der Grund, warum sie nicht sehr geeignet ist für langfristige intermittierende Anwendungen. Dies ist der Hauptgrund, warum die Magnesiumbatterie an Popularität verliert und Lithiumbatterien ihren Markt übernehmen.
Chemie der Magnesiumbatterie
In primären Magnesiumbatterien wird ein Magnesiumlegierung als Anode verwendet; Mangan-Dioxid dient als Kathodenmaterial. Allerdings kann Mangan-Dioxid der Kathode die erforderliche Leitfähigkeit nicht bieten, weshalb Acetylenschwarz mit Mangan-Dioxid gemischt wird, um die erforderliche Leitfähigkeit zu erzielen. Als Elektrolyt wird Magnesiumperchlorat verwendet. Barium- und Lithiumchromat werden dem Elektrolyt hinzugefügt, um Korrosion zu verhindern. Magnesiumhydroxid wird ebenfalls dieser Mischung als Pufferstoff hinzugefügt, um die Lagerfähigkeit zu verbessern.
Die Oxidationsreaktion, die in der Anode stattfindet, ist,


Die Reduktionsreaktion, die in der Kathode stattfindet, ist,


Gesamtreaktion,


Die Leerlaufspannung, die diese Zelle liefert, beträgt etwa 2 Volt, aber der theoretische Wert des Zellpotentials beträgt 2,8 Volt.
Die Wahrscheinlichkeit von Magnesiumkorrosion ist sogar unter extremen Umweltbedingungen sehr gering. Rohmagnesium reagiert mit Feuchtigkeit und bildet eine dünne Schicht von Mg(OH)2 auf seiner Oberfläche.
Diese dünne Schicht von Magnesiumperoxid dient als korrosionsgeschützende Schicht über dem Magnesium. Darüber hinaus verbessert eine Chromatbehandlung dieses Schutzmaßnahmen in großem Maße. Wenn jedoch diese schützende Schicht von Magnesiumperoxid durch die Entladung der Batterie perforiert oder entfernt wird, findet Korrosion mit Bildung von Wasserstoffgas statt.


Dies ist die grundlegende Chemie der Magnesiumbatterie.
Aufbau der Magnesiumbatterie
Konstruktiv ist eine zylindrische Magnesiumbatteriezelle ähnlich einer zylindrischen Zink-Kohlenstoff-Batteriezelle. Hier wird eine Legierung aus Magnesium als Hauptbehältnis der Batterie verwendet. Diese Legierung besteht aus Magnesium und einer kleinen Menge Aluminium und Zink. Hier wird Mangan-Dioxid als Kathodenmaterial verwendet. Da Mangan-Dioxid eine schlechte Leitfähigkeit hat, wird Acetylenschwarz damit gemischt, um seine Leitfähigkeit zu verbessern. Dies hilft auch, Wasser im Kathodenbereich zu halten. In dieser Kathodenmischung wird Bariumchromat als Inhibitor hinzugefügt, und Magnesiumhydroxid wird als pH-Puffer hinzugefügt. Magnesiumperchlorat mit Lithiumchromat, gemischt mit Wasser, wird als Elektrolyt verwendet. Kohlenstoff wird in die Kathodenmischung als Stromsammelstab eingefügt. Kraftpapiere, die mit Elektrolytlösung getränkt sind, werden zwischen Kathoden- und Anodenmaterialien als Trennschichten platziert. Bei der Konstruktion der Abdichtung in Magnesiumbatterien muss besondere Sorgfalt walten. Die Abdichtung der Batterie sollte nicht so porös sein, dass die Feuchtigkeit innerhalb der Batterie während der Lagerung verdunstet, und sie sollte nicht so undurchlässig sein, dass das während der Entladung gebildete Wasserstoffgas nicht entweichen kann. Die Abdichtung der Batterie sollte die Feuchtigkeit innerhalb der Batterie halten und gleichzeitig genügend Abluft für das gebildete Wasserstoffgas bieten. Dies kann erreicht werden, indem ein kleines Loch in der Plastabdichtung unter dem Haltering angebracht wird. Wenn überschüssiges Gas durch das Loch austritt, wird der Haltring durch den Druck verformt, was das Entweichen des Gases ermöglicht.
a
Magnesiumanode bildet die äußere Hülle der Batterie, aber es gibt auch eine andere Konstruktion der Magnesiumbatterie, bei der Kohlenstoff den äußeren Behälter der Batterie bildet. Hier wird ein typischer Behälter aus hoch leitfähigem Kohlenstoff in Form eines zylindrischen Bechers gebildet, und eine stangenförmige Struktur ragt aus seinem Zentrum, wie im Bild gezeigt. Die Batterieanode wird durch einen Zylinder oder Trommel aus Magnesium gebildet. Der Durchmesser des zylindrischen Anoden ist etwa die Hälfte des Kohlenstoffbechers. Das Kathodenmischmaterial wird innerhalb dieses Anodenzylinders platziert und von der inneren Wand des Zylinders durch ein Papiergetrennter getrennt. Der Raum zwischen der inneren Oberfläche des Kohlenstoffbechers und der äußeren Oberfläche des Anodenzylinders wird ebenfalls mit Kathodenmischmaterial gefüllt, und hier wird die äußere Oberfläche des Anodenzylinders ebenfalls durch ein Papiergetrennter vom Kathodenmischmaterial getrennt. Das Kathodenmischmaterial wird durch das Mischen von Mangan-Dioxid, Kohlenstoffschwarz und einer kleinen Menge wässrigen Magnesiumbromid oder Perchlorat als Elektrolyt hergestellt. Der positive Pol wird am Ende des Kohlenstoffbechers angeschlossen. Der negative Pol wird am Ende des Anodentrommels angeschlossen. Das gesamte System wird in einer geknickten, zinnbeschichteten Stahljacke eingeschlossen.
Vorteile der Magnesiumbatterie
Sie hat eine sehr gute Selbsthaltefähigkeit; sie kann über lange Zeit, sogar bei hohen Temperaturen, gelagert werden. Diese Batterien können bis zu 5 Jahre bei einer Temperatur von 20oC gelagert werden.
Sie hat doppelt so viel Kapazität im Vergleich zu einer gleich großen Leclanche-Batterie.
Höhere Batterie-Spannung als Zink-Kohlenstoff-Batterie.
Die Kosten sind auch moderat.
Nachteile der Magnesiumbatterie
Verzögerung (Spannungsverzögerung).
Entwicklung von Wasserstoff während der Entladung.
Wärmeentwicklung während der Nutzung.
Schlechte Lagerfähigkeit nach partieller Entladung.
Die Batterien werden kommerziell nicht mehr hergestellt.
Größen und Typen von Mg/MnO2-Batterien
Zylindrische Magnesium-Primärbatterien
| Batterietyp |
Durchmesser in mm |
Höhe in mm |
Gewicht in g |
Kapazität in Ah |
| N |
11 |
31 |
5 |
0,5 |
| B |
19,2 |
53 |
26,5 |
2 |
| C |
25,4 |
49,7 |
45 |
3 |
|
Spende und ermutige den Autor
Zusammensetzung und Arbeitsprinzip von Photovoltaik-Stromerzeugungssystemen
Zusammensetzung und Arbeitsprinzip von Photovoltaik-(PV)-StromerzeugungssystemenEin Photovoltaik-(PV)-Stromerzeugungssystem besteht hauptsächlich aus PV-Modulen, einem Regler, einem Wechselrichter, Batterien und anderen Zubehörteilen (Batterien sind für an das Stromnetz angeschlossene Systeme nicht erforderlich). Abhängig davon, ob sie auf das öffentliche Stromnetz angewiesen sind, werden PV-Systeme in Stand-alone- und Netzverbundsysteme unterteilt. Stand-alone-Systeme arbeiten unabhängig vom Ve
Wie man eine PV-Anlage pflegt? State Grid beantwortet 8 häufige O&M-Fragen (2)
1. An einem heißen, sonnigen Tag, müssen beschädigte empfindliche Komponenten sofort ersetzt werden?Eine sofortige Ersetzung wird nicht empfohlen. Falls eine Ersetzung notwendig ist, sollte sie am frühen Morgen oder späten Nachmittag durchgeführt werden. Sie sollten sich unverzüglich mit dem Betriebs- und Wartungspersonal (O&M) des Kraftwerks in Verbindung setzen und Fachpersonal zur Stelle schicken, um die Ersetzung vorzunehmen.2. Um Photovoltaikmodule (PV) vor Treffern durch schwere Gegens
Wie man eine PV-Anlage pflegt? State Grid beantwortet 8 häufige O&M-Fragen (1)
1. Welche häufigen Störungen treten in dezentralen Photovoltaik-(PV)-Stromerzeugungssystemen auf? Welche typischen Probleme können in den verschiedenen Komponenten des Systems auftreten?Häufige Störungen umfassen das Ausbleiben der Funktion oder des Starts von Wechselrichtern, da die Spannung den Startwert nicht erreicht, und eine geringe Stromerzeugung aufgrund von Problemen mit den PV-Modulen oder den Wechselrichtern. Typische Probleme, die in den Systemkomponenten auftreten können, sind das V
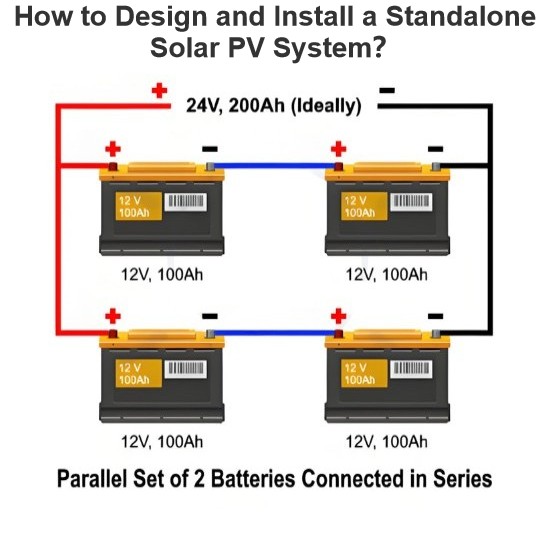
Wie entwerfen und installieren Sie ein eigenständiges Solar-PV-System
Planung und Installation von Solar-PV-SystemenDie moderne Gesellschaft ist auf Energie für tägliche Bedürfnisse wie Industrie, Heizung, Verkehr und Landwirtschaft angewiesen, die hauptsächlich durch nicht erneuerbare Energien (Kohle, Öl, Gas) gedeckt werden. Diese verursachen jedoch Umweltschäden, sind ungleichmäßig verteilt und unterliegen aufgrund begrenzter Vorräte Preisschwankungen, was die Nachfrage nach erneuerbarer Energie anheizt.Solarenergie, die reichlich vorhanden und in der Lage ist,
IEE-Business-Anwendung abrufen
Nutzen Sie die IEE-Business-App um Geräte zu finden Lösungen zu erhalten Experten zu kontaktieren und an Branchenkooperationen teilzunehmen jederzeit und überall zur vollen Unterstützung Ihrer Stromprojekte und Ihres Geschäfts.
|